Пересадка части органа от животных-химер излечит диабет
Инсулин продуцирующие участки поджелудочной железы, выращенные у генетически модифицированных животных, излечивают диабет у животных других видов, что представляется перспективным для лечения диабета человека путем выращивания человеческой поджелудочной железы у химерных животных
В январе 2017 г. исследователи из Стэндфордского медицинского центра, Калифорния, США и Университета Токио в Японии опубликовали результаты исследований того, как ведут себя продуцирующие инсулин участки поджелудочной железы, выращенные в крысах, если их пересадить мышам, болеющим экспериментальным диабетом 1 типа. То, что они получили, имеет неоценимую научную и практическую ценность для будущего медицины.
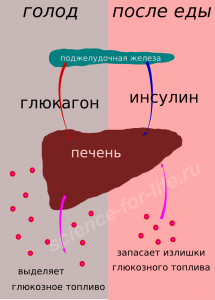
Диабет 1 типа – это опасное и неизлечимое в настоящее время эндокринное заболевание. Участки поджелудочной железы, в норме вырабатывающие инсулин, у больных людей инсулин не производят. Если в организме нет инсулина, то сахар крови повышается настолько, что это быстро приводит к таким серьезным осложнениям как инсульты, болезни сердца, отказ функции почек и потеря зрения. Такие больные нуждаются во введении инсулина в виде инъекций ежедневно и пожизненно.
Ученые-медики уже многие годы пытаются проводить трансплантацию или пересадку здоровых участков поджелудочной железы от доноров к больным людям, чтобы вылечить диабет. Однако эти манипуляции не всегда заканчиваются успехом из-за отторжения организмом человека чужих тканей, даже если пересадка происходит от человека к человеку.
Теоретически существует и другое направление добиться излечения диабета – это вырастить искусственную поджелудочную железу в лаборатории из исходных так называемых стволовых клеток человека. Однако такие органы “в пробирке” по многим причинам не растут.
Ученые, о которых мы пишем, начали еще начале 2000 годов с того, что стали выращивать поджелудочную железу крысы в мышах, у которых была искусственно изменена наследственность таким образом, что у них не развивалась поджелудочная железа. Таких животных обозначают Pdx1(-/-) (неспособные развивать панкреас), иначе говоря, экспериментальные мыши с врожденным дефектом – отсутствием поджелудочной железы. Конечно, такие мыши могут жить только в лаборатории, когда им постоянно вводят инсулин, и таких мышек, конечно же, немного жалко. Этим мышам на стадии раннего зародыша – бластоцисты – вводили так называемые плюрипотентные стволовые клетки крыс. Это разновидность стволовых клеток, о которых сейчас много пишут. Плюрипотентные стволовые клетки отличаются способностью к превращению в любые другие клетки тканей организма. Из таких клеток могут развиваться даже целые органы. В таких экспериментах ученым удалось вырастить у мышей поджелудочную железу крыс, которая нормально вырабатывала инсулин и фактически давала здоровую жизнь мышам, которые должны были страдать врожденным диабетом. Результаты этого исследования были опубликованы в 2010 г. Однако, тогда не удалось успешно пересадить химерную поджелудочную железу обратно к экспериментальной крысе, чтобы вылечить ее от диабета. Причина была в том, что у мыши развивалась поджелудочная железа небольшого мышиного размера, и она не подходила крысам по размерам. Так, по крайней мере, решили ученые и не ошиблись.
В последующие годы исследовали повторили эксперимент, но поменяли местами крыс и мышей. Они подобным же образом вырастили поджелудочную железу мыши в Pdx-1 крысах. После этого мышам, у которых был искусственно вызван диабет, пересаживали поджелудочную железу от химерных крыс. Чтобы не наступило отторжения пересаженных тканей чужого организма, тем более принадлежащего к другому виду, мышам в течение 5 дней вводили иммунодепрессанты. Крысиная поджелудочная железа приживалась и мыши становились здоровыми практически на всю жизнь. Удивительно оказалось то, что когда ученые исследовали поджелудочную железу у этих мышей через год, они выяснили, что в ней нет клеток крыс. Вероятно все крысиные клетки были уничтожены иммунной защитной системой мышей как чужеродные. Однако это, судя по всему, происходило постепенно в процессе функционирования поджелудочной железы мыши, которая продолжала вырабатывать инсулин. В конце 2016 г. эксперимент был закончен. Чтобы убедиться в достоверности выводов, исследователи сделали 100 повторов на сотне крыс и мышей.
Таким образом, ученые доказали, что поджелудочную железу для человека можно выращивать и в других видах животных, например, в свиньях. Части поджелудочной железы такой химерной свиньи можно будет пересадить человеку, у которого не происходит выработки собственного инсулина, и у такого человека постепенно образуется нормально работающая поджелудочная железа, а клетки свиньи заменятся на свои человеческие клетки.
Вы спросите «А когда это произойдет?» Мы будем отслеживать как будут дальше развиваться события в передовой мировой медицине и опубликуем это на нашем Сайте. Смотрите продолжение на страницах Стволовые клетки и Химерные животные; эти страницы скоро появятся на Сайте.